 |
Skema cara kerja PLTG
|
Sabtu, 28 Maret 2015
Jumat, 20 Maret 2015
Perubahan Fase Zat
Diagram perubahan
wujud
Perubahan
wujud zat adalah perubahan termodinamika dari
satu fase benda ke
keadaan wujud zat yang
lain.zat ini bisa terjadi karena peristiwa pelepasan dan penyerapan
kalor.Perubahan wujud zat terjadi ketika titik tertentu tercapai oleh
atam/senyawa zat tersebut yang biasanya dikuantitaskan dalam angka suhu.
Semisal air untuk menjadi padat harus mencapai titik bekunya dan air menjadi
gas harus mencapai titik didihnya.
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (PLTS)
Listrik yang kita
nikmati saat ini untuk menyalakan berbagai alat elektronik ini adalah listrik
yang dihasilkan dari proses pembakaran bahan bakar fosil seperti batu bara,
minyak atau gas bumi. Dan hasil pembakaran tersebut nantinya akan menghasilkan
gas buang karbon dioksida yang bisa merusak lingkungan.Maka dari itu, para
ilmuwan mempercayai bahwa salah satu hal yang mempengaruhi pemanasan global dan
perubahan iklim ekstrim di bumi adalah proses pembakaran tersebut. Maka dari
itu penggunaan listrik tenaga surya saat ini dinilai sebagai salah satu
alternatif untuk bisa mencegah dan mengurangi pemanasan global.
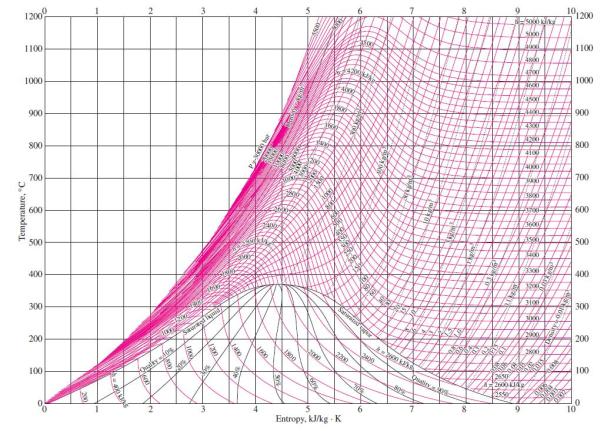
Siklus Rankine
Siklus Rankine adalah siklus daya uap yang digunakan untuk menghitung atau memodelkan proses kerja mesin uap / turbin uap. Siklus ini bekerja dengan fluida kerja air. Semua PLTU (pembangkit listrik tenaga uap) bekerja berdasarkan prinsip kerja siklus Rankine. Siklus Rankine pertama kali dimodelkan oleh: William John Macquorn Rankine, seorang ilmuan Scotlandia dari Universitas Glasglow. Untuk mempelajari siklus Rankine, terlebih dahulu kita harus memahami tentang T-s diagram untuk air. Berikut ini adalah T-s diagram untuk air.
Kamis, 19 Maret 2015
Osmosis
Definisi Osmosis
Osmosis ialah peristiwa perpindahan pelarut dari larutan yang konsentrasinya lebih kecil (encer) ke larutan yang konsentrasinya lebih besar (pekat) melalui membran semi permianel.
Perpindahan Kalor
Bila diperhatikan misalnya jumlah energi kalor api unggun kayu
yang ditumpukkan, semua ini .menyimpan sejumiah energi dalam yang ditandai
dengan kuantitas yang lazim disebut muatan kalor bahan. Apabila api dinyalakan,
energi terma yang tersimpan di dalam bahan tadi akan bertukar menjadi energi
kalor yang dapat kita rasakan. Energi kalor ini mengalir jika terdapat suatu
perbedaan suhu. Bila diperhatikan sebatang logam yang dicelupkan ke dalam suatu
tangki yang berisi air kalor. Karena suhu awal logam ialah T1 dan suhu air
ialah T2, dengan T2 >> T1, maka logam dikatakan lebih dingin daripada
air. Hal yang penting dalam sistem yang terdiri dari air dan logam ialah adanya
suatu perbedaan suhu yang nyata yaitu (T2- T1).
Hukum Raoult
Hukum Raoult adalah hukum yang dicetuskan oleh Francois M. van Raoult (1830-1901) untuk mempelajari sifat-sifat tekanan uap larutan yang mengandung zat pelarut yang bersifat nonvolatil, serta membahas mengenai aktivitas air.
Proses Reversibel dan Ireversibel
Proses reversibel
adalah proses termodinamik yang dapat berlanggsung secara bolak-balik. Sebuah
sistem yang mengalami idealisasi proses reversibel selalu mendekati keadaan
kesetimbangan termodinamika antara sistem itu sendiri dan lingkungannya. Proses
reversibel merupakan proses seperti-kesetimbangan (quasi
equilibrium process). Proses
yang dapat dibalik arahnya dinamakan proses reversibel.
ENTALPI DAN PERUBAHAN ENTALPI
Entalpi (H) adalah jumlah energi yang dimiliki sistem pada tekanan tetap. Entalpi (H) dirumuskan sebagai jumlah energi yang terkandung dalam sistem (E) dan kerja (W).
H = E + W
dengan:
W = P × V
E = energi (joule)
W = kerja sistem (joule)
V = volume (liter)
P = tekanan (atm)
Hukum kekekalan energi menjelaskan bahwa energi tidak dapat diciptakan dan tidak dapat dimusnahkan, tetapi hanya dapat diubah dari bentuk energi yang satu menjadi bentuk energi yang lain. Nilai energi suatu materi tidak dapat diukur, yang dapat diukur hanyalah perubahan energi (ΔE). Demikian juga halnya dengan entalpi, entalpi tidak dapat diukur, kita hanya dapat mengukur perubahan entalpi (ΔH).
ΔH = Hp – Hr
dengan:
ΔH = perubahan entalpi
Hp = entalpi produk
Hr = entalpi reaktan atau pereaksi
a. Bila H produk > H reaktan, maka ΔH bertanda positif, berarti terjadi penyerapan kalor dari lingkungan ke sistem.
b. Bila H reaktan > H produk, maka ΔH bertanda negatif, berarti terjadi pelepasan kalor dari sistem ke lingkungan.

Ilmuwan Termodinamika (James Prescott Joule)
James Prescott Joule (lahir
di Salford, Inggris, 24 Desember 1818. Meninggal
di Greater Manchester, Inggris, 11 Oktober 1889 pada umur 70
tahun) ialah seorang ilmuwan Inggris. Ia dikenal sebagai perumus Hukum Kekekalan Energi, yang berbunyi,
“Energi tidak
dapat diciptakan ataupun dimusnahkan.”
FUGASITAS
Fugasitas adalah besaran dari suatu tekanan ekuivalen yang
dinyatakan dalam dimensi tekanan sebagai pengganti tekanan p menurut hukum gas
ideal. Pada gas tidak ideal perhitungan dipermudah dengan mengganti
tekanan dari besaran tersebut. Fugasitas di fasa uap dinyatakan dalam
bentuk koefisien fugasitas yang didefinisikan sebagai perbandingan antara
fugasitas di fasa uap dan tekanan parsial komponen. Sedangkan, fugasitas
di fasa cair umumnya dinyatakan dalam bentuk koefisien aktifitas
yangdidefinisikan sebagai perbandingan antara fugasitas di fasa cair dan hasil
kali antarafraksi mol komponen di fasa cair dan fugasitas komponen pada keadaan
standar dalam perhitungan-perhitungan koefisien aktifitas adalah kondisi cairan
murni.
LEBIH LENGKAP LAGI TENTANG FUGASITAS:
http://akademik.che.itb.ac.id/labtek/wp-content/uploads/2009/02/modul-103-kesetimbangan-uap-cair.pdf
Sub Bagian Termodinamika
1.1. Sisitem, Keliling, Keadaan Sistem, dan
Variabel Keadaan
Sistem termodinamika
adalah bagian dari alam semesta fisik yang ada dalam pengamatan. Sistem
tersebut terpisah dari kelilingnya oleh suatu batas. Bila batas mencegah setiap
antaraksi dengan keliling, sistem tersebut adalah sistem terisolasi. Bila
materi dapat melewati batas, maka didapat sistem terbuka. Apabila tak mungkin,
maka didapat sistem tertutup. Kalor dapat masuk dan keluar dari sistem
tertutup, dan kerja dapat dilakukan pada atau oleh sisitem tertutup.
Suatu
sistem dapat diambil lewat deretan perubahan di mana kerja dan kalor lewat
batas sedemikian rapat sehingga ada perubahan dalam keliling maupun dalam system.
Bila batas tak memungkinkan aliran kalor, maka setiap proses yang berlangsung
dalam sistem dikatakan adiabat; dan batasnya disebut dinding adiabat.
Bila system ada dalam kesetimbangan
pada kondisi tertentu, maka dikatakan ada pada keadaan tertentu. Keadaan system
dapat diidentifikasi dari fakta bahwa dalam keadaan tertentu, setiap sifatnya
mempunyai nilai tertentu. Telah didapatkan, bahwa setiap untuk sejumlah fluida
suatu komponen yang tertentu banyaknya (gas atau cairan), keadaan dapat
ditentukan oleh dua dari tiga variabel (tekanan, volum, dan suhu). Variabel
yang seperti itu adalah variabel keadaan.
1.2.
Besaran termodinamika ekstensif dan intensif
Bila ukuran system termodinamika
diperbesar dua kali tanpa perubahan lain, besaran termodinamika tertentu yang
dapat digunakan. Untuk menggambarkan system, juga diperbesar dua kali. Contoh adalah
volum system dan energinya. Besaran termodinamika
demikian disebut ekstensif. Sifat termodinamika yang lain, seperti suhu dan
tekanan, tak dipengaruhi oleh perubahan ukuran system, sehingga disebut sifat intensif.
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (Garam)
Garam merupakan komoditas yang sangat penting
bagi kehidupan masyarakat kita, bayangkan saja jika tidak ada garam akan hambar
terasa hidup kita begitu kata pepatah mengatakan. Garam tidak hanya bisa
dijadikan bahan konsumsi namun garam juga bisa dikategorikan dalam bahan
industri, seperti industri penyamakan kulit, pengeboran minyak lepas pantai dll.
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (Oven)
Anda pasti pernah melihat oven microwave kan?? Jika belum,
pernatikan gambar ini.
Oven microwave merupakan perangkat yang dengan cepat telah
menjadi alat masak populer. kelebuhannya adalah menghemat waktu dan hemat
listrik, karena tidak perlu dipanaskan terlebih dahulu seperti alat masak
lainnya yang perlu dipanaskan terlebih dahulu. Prinsip kerja dari alat ini
(oven microwave) adalah perpindahan kalor secara radiasi.
Rabu, 18 Maret 2015
Kapasitas Kalor
Pengertian Kapasitas
Kalor Gas
Kapasitas kalor C suatu zat menyatakan "banyaknya kalor
Q yang diperlukan untuk menaikkan suhu zat sebesar 1 kelvin".
Pernyataan ini dapat dituliskan secara matematis sebagai
Selasa, 17 Maret 2015
Kalorimetri
Kalorimetri
adalah ilmu dalam pengukuran panas dan reaksi kimia atau perubahan fisik. Pada
kalorimetri ini dapat melakukan pengukuran perubahan kalor yang bergantung pada
pemahaman tentang kalor jenis dan kapasitas kalor. Dengan demikian kita dapat
mengetahui suhu pada suatu ruangan atau benda-benda lainnya. pengukuran panas
ini sangat bermanfaat diberbagai bidang, salah satunya adalah kesehatan.
Kalorimetri Volume-Konstan
KALOR
Pengertian Kalor
Kalor didefinisikan sebagai energi panas yang dimiliki
oleh suatu zat. Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh
suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka
kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika
suhunya rendah maka kalor yang dikandung sedikit.
Dari hasil percobaan yang
sering dilakukan besar kecilnya kalor yang dibutuhkan suatu benda (zat)
bergantung pada 3 faktor, yaitu:
1.
massa zat
2.
jenis zat
(kalor jenis)
3.
perubahan
suhu
Minggu, 15 Maret 2015
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (Pemanas Air Wika)
Komponen utama Pemanas air Wika terdiri dari panel kolektor dan tangki yang dihubungkan dengan dua pipa assesories. Panel kolektor pada WIKA solar water heater dilengkapi dengan penutup kaca berfungsi sebagai penangkap panas sinar matahari yang didalamnya tersusun rangkaian pipa tembaga sebagai jalur air yang dibalut sirip absorber.
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (Termometer Bimetal)
Termometer Bimetal Mekanik
adalah sebuah termometer yang terbuat dari dua buah kepingan logam yang
memiliki koefisien muai berbeda yang dikeling (dipelat) menjadi satu. Kata bimetal sendiri
memiliki arti yaitu "bi" berarti dua sedangkan kata "metal" berarti
logam, sehingga bimetal berarti "dua logam".
Sabtu, 14 Maret 2015
Aplikasi Termodinamika dalam Kehidupan Sehari-hari (Dispenser)
Dispenser adalah salah satu alat
rumah tangga yang menggunakan listrik untuk dapat memanaskan elemen pemanas dan
menjalankan mesin pendinginnya. Dispenser ada yang menggunakan prinsip kerja
dengan elemen pemanas dan mesin pendingin(compressor). Dispenser atau
tempat air minum adalah salah satu peralatan listrik atau elektronik yang
didalamnya terdapat heater sebagai komponen utamanya, heater berfungsi untuk
memanaskan air yang ada pada tabung penampung, Heater umumnya memiliki daya
sekitar 200-300 Watt. Heater dapat memanaskan air yang terdapat di dalam
dispenser. Biasanya dispenser berisi 19 liter air, yang di tempatkan paada
sebuah galon.
Hukum Termodinamika I
Panas dan kerja, keduanya dalah bentuk perpindahan energi ke dalam atau keluar sistem; mereka dapat dibayangkan sebagai energi dalam keadaan singgah. Jika perubahan energi disebabkan oleh kontak mekanik sistem dengan lingkungannya, maka kerja dilakukan; jika perubahan itu disebabkan oleh kontak kalor (menyebabkan persamaan suhu), maka kalor dipindahkan. Dalam banyak proses, kalor dan kerja keduanya menembus batas sistem, dan perubahan energi dalam sistem adalah jumlah dari kedua kontribusi itu.
HUKUM
I TERMODINAMIKA disebut juga hukum kekekalan tenaga. Isi hukum tersebut adalah:
"Energi
tidak dapat diciptakan atau dimusnahkan, dengan kata lain bila suatu energi
hilang akan timbul energi dalam bentuk
lain, yang jumlahnya sama."
Langganan:
Komentar (Atom)


.jpg)






.jpg)










